오늘은 주기율표를 소개해드리면서 주기율표에 숨겨진 역사에 대해서 알아보는 시간을 갖도록 하겠습니다.
주기율표는 보통 중학교 과학시간에 처음 접하게 됩니다. 중학교 수준의 과학에서는 주기율표를 외우라고 하지는 않지만 고등학교에 가면 어느 정도는 암기할 것이 요구 됩니다.
개인적으로 제가 다녔던 중학교에는 큼지막한 주기율표가 걸려있었습니다. 그 주기율표를 보면서 화학자의 꿈을 키웠다는 말도 안되는 소리를 해봅니다.
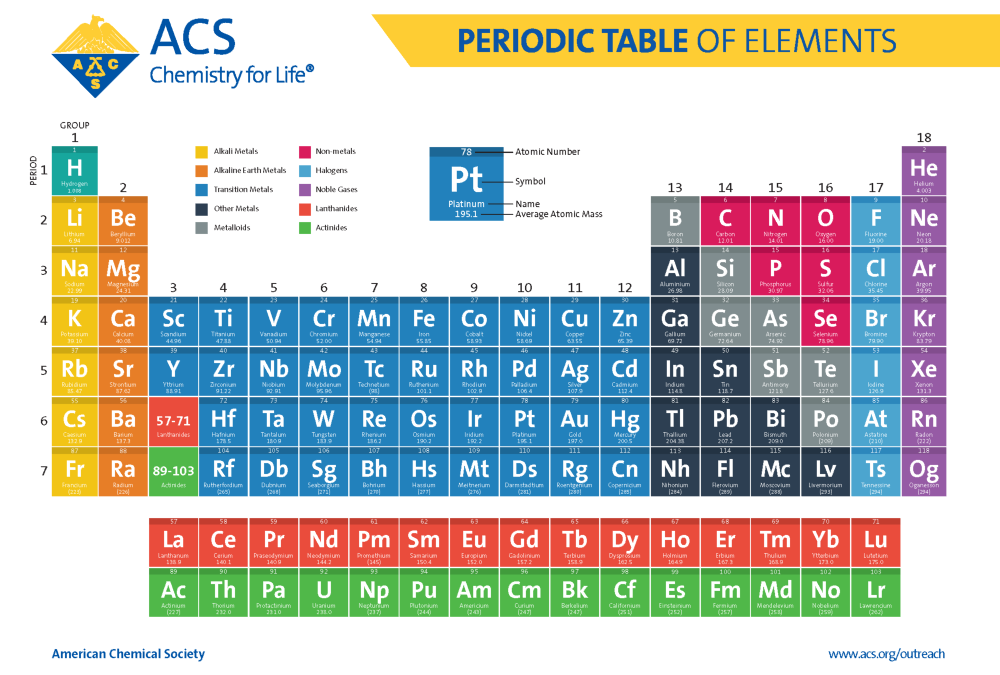
1. 주기율표의 소개
주기율표는 118개의 원소를 여러가지 경향성에 따라서 분류 및 나열해 놓은 표입니다. 가로방향을 주기 (Period)라고 하고 세로 방향을 족 (Group) 이라고 부릅니다. 이 주기율표는 자연에서 발견된 원소에서부터 연구자들에 의해서 만들어진 원소까지 다양하게 구성되어 있습니다. 여튼 이 주기율표는 온통 알 수 없는 영어로 이루어져 있습니다. 그래서인지 처음에는 조금 접근하기가 쉽지 않습니다. 심지어 영어로 쓰여져 있지만 영어가 아닌 것들도 있습니다. 가령 47번의 Ag는 silver이고 79번의 Au는 Gold 입니다. 영어 이름의 어디에서도 Ag 나 Au를 찾아 볼 수 가 없습니다. 왜냐면 Ag 와 Au는 각각 라틴어의 Argentum과 Aurum에서 온 약자이기 때문입니다. 국가마다 부르는 이름도 다릅니다. Na (11번)은 유럽국가에서는 Natrium이라고 부르지만 미주국가에서는 Sodium이라고 부릅니다. 그리고 K (19번)은 유럽국가에서는 Kalium이라고 부르지만 미주국가에서는 Potassium이라고 부릅니다이름 이야기가 나온김에 잠시 몇 가지 이름들의 유래를 소개해 드려보겠습니다. 일본의 연구소 Riken에서 만들어낸 Nihonium (113번)은 일본을 부르는 Nihon에서 기인하였습니다. 그리고 원자번호 110번의 Darmstadtium은 독일의 Darmstadt에 위치한 GSI Helmholtz Centre for Heavy Ion Research에서 개발되었습니다. 아쉽게도 한국에서 발견 및 개발된 원소는 없습니다. 여러분께서...
이름부터 시작해서 여러모로 주기율표가 상당히 복잡해보이지만 저는 여러분들께 주기율표는 어느 정도 외우고 계신것이 편하다고 말씀드리고 싶습니다. 왜냐하면 앞서 말씀드린바와 같이 현재 우리가 배우는 주기율표는 경향성을 바탕으로 작성된 표 이기 때문에 화학의 기본인 주기율표를 통해서 여러 반응성의 예측까지도 제공하기 때문입니다. 가령 Ir (77번)을 촉매로 하는 반응이 Rh (45번)에서도 가능할 수 있음을 예상 할 수 있고 Ru (44번)을 포함하는 complex는 Os(76번)을 포함하는 complex와 유사한 성질을 가질 수도 있음을 예측할 수 있습니다. 또한 주기율표의 아래로 갈 수록 무른점(Soft)과 위로 갈 수록 단단해짐(hard)을 이용하여 HSAB (Hard Soft Acid Base) 이론에 대한 경향성을 예측할 수 도 있습니다.
예를 들어 BTS 주기율표를 키라는 경향성을 가지고 아래와 같이 정렬했다고 가정해 봅시다.
랩몬스터 (181) - 진 (179) - 뷔 (178) - 정국 (178) - 제이홉 (XXX) - 지민 (174) - 슈가 (174)
그렇다면 제이홉은 178보다는 작지만 174보다 크다라는 예측을 할 수 있을 것입니다. 또한 멤버들을 일렬로 세울 때 랩몬스터와 슈가를 옆에 세우면 키 차이가 많이 나 보일 수 있겠다 라는 점까지도 고려할 수 있을 것입니다. 이렇게 주기율표도 연구자에게 화학에 있어서 경향성을 제공해줌과 동시에 실험을 어떠한 방향으로 진행해야하는 지에 대한 나침반의 역할도 합니다.
2. 주기율표의 역사
주기율표의 역사는 요한 볼프강 되베라이너(Johann Wolfgang Döbereiner)가 처음 제시한 세 쌍 원소 법칙 (Law of Triads)에서부터 시작합니다. 이 법칙은 [Lithium-Sodium-Potassium], [Calcium-Strontium-Barium], [Chlorine-Bromine-Iodine]과 같이 세 원소들을 한 무리로 묶었을 때, 첫 번째와 세 번째의 원자량 평균이 두번째 원자와 같다는 이론에서 출발하였습니다. 하지만 이 법칙에 해당하는 예시가 별로 없기 때문에 당시에는 주목받지 못했으나 이 묶음이 현대 주기율표에서 같은 족에 해당한다는 점에서 그리고 처음으로 이러한 경향성을 밝혀낸 점에서 상당한 발견이라고 생각됩니다.
이후에도 정말 많은 연구자들이 그들만의 주기율표를 통해서 알려진 원소들을 정렬하려고 노력했습니다. 프랑스의 Alexandre-Émile Béguyer de Chancourtois (알렉산드레-에밀 베기어 드 샹크루투아) , 독일의 Julius Lothar Meyer (율리우스 로타 마이어), 영국의 William Odling (윌리엄 오드링)과 John Newlands (존 뉴랜즈), 미국의 Gustavus Hinrichs (구스타프스 힌리히스)가 1860년대 다양한 방식의 주기율표를 제시하였습니다. 이 중에 하나가 우리가 잘 알고 있는 John Newlands의 옥타브 법칙입니다. 원자량의 순으로 원소를 배열하면 피아노 건반 처럼 8번째 원소마다 성질이 비슷한 원소가 나타난다는 법칙입니다.
비슷한 시기에 러시아의 화학교수인 Dmitri Mendeleev (드미트리 멘델레예프)는 앞서 개발된 주기율표들로부터 착안하여 현대 주기율표와 가장 유사한 주기율표를 만들게 됩니다. (Reference: Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente. Zeitschrift für Chemie, 12, 405-406)

그런데 여타 주기율표와는 다르게 Mendeleev의 주기율표에는 빈칸이 있다라는 것이 획기적인 부분이었고 이 빈칸에 채워질 원소가 존재함을 예측하기까지 하였습니다. 가령 당시에는 발견되지 않았던 원소를 ekasilicon, ekaaluminium, ekaboron라 부르고 이 원소들의 존재와 특성을 예측하였는데 이는 후에 germanium, gallium, scandium으로 밝혀졌고 예측한 원소의 물리적 화학적 특성이 거의 유사하게 맞아 떨어졌습니다.
이후, Ernest Rutherford (에른스트 러더포드)가 원자 핵을 발견하고 이어서 Henry Moseley (헨리 모즐리)가 X선의 파장을 통해 이를 실험적으로 입증하면서 Dmitri Mendeleev의 주기율표가 핵전하의 순서에 맞게 정렬되어 있음을 다시한번 밝혔습니다. 그리고 이를 기본으로 하여 우리가 보고 배우는 주기율표가 탄생하게 되었습니다.
자, 오늘은 주기율표에 대해서 간략히 알아 보았습니다. 이번 글을 통해서 여러분들이 주기율표와 조금 더 가까워 지는 시간이 되었으면 합니다. 다음 시간에는 주기율표에 속해 있는 여러 원소들에 대해서 차근 차근 알아보도록 하겠습니다.
2021/01/20 - [화학을 배웁니다/화학 이론] - 주기율표 2 (족과 주기)
주기율표 2 (족과 주기)
지난시간에는 주기율표를 소개해 드리면서 역사에 대해서 알아보는 시간을 가졌습니다. 혹시 지난번 내용이 궁금하신 분들이 아래 링크를 이용해주세요. 2021/01/04 - [화학을 배웁니다/화학 이론]
chemistry-station.tistory.com
이상 화학 발전소였습니다.
질문은 댓글로!
유용하게 보셨다면 좋아요!
부탁드려요!
'화학을 배웁니다 > 화학 이론' 카테고리의 다른 글
| 주기율표 3 (오비탈, 쌓음 원리) (0) | 2021.01.24 |
|---|---|
| 주기율표 2 (족과 주기) (2) | 2021.01.20 |
| 화학 작용기 (Functional Groups) (0) | 2020.12.30 |
| 화학의 정의 (0) | 2020.11.23 |
| 탄소 화합물 (Compounds of Carbon) 1 (0) | 2020.11.19 |
